我司邀请大牌评审专家齐聚北京,全面深入解析保健食品、特医食品新法
2016-10-24
2016年3月25-27日,由中国老年学会老年营养与食品专业委员会主办,北京新伦鸿图科技有限公司承办,北京中健天行医药科技有限公司支持协办的“2016保健食品和特殊膳食研发与申报注册研讨会”在京成功举办。本次研讨会有众多大牌评审专家出席,演讲报告紧扣《保健食品注册与备案管理办法》、《保健食品原料目录》(征求意见稿)及《特殊医学用途配方食品注册管理办法》等新规文件,向与会者就保健食品、特医食品的政策法规及研发趋势做了全面深入解读。


福建省疾病预防控制中心主任技师,现国家食品药品监督管理总局保健食品安全专家委员会副主任委员林升清在会中,以《对保健食品管理新模式的理解与产业发展趋势》为主题,对将于7月1日起施行的《保健食品注册与备案管理办法》做了技术型解析。

林升清认为,新办法的公布,表明我国保健食品监管实现了由完全审批向备案和审批相结合模式的过渡,这是我国保健食品行业的一大显著跨进。新规强调注册审评人自主研发,在完成配方、工艺、中试研究及理化、毒理、功能评价等综合研究之前,省级食药监局不再以开展样品检验封样方式介入产品研发,将以受理为起点,将生产现场核查和复核检验调至技术审评环节。
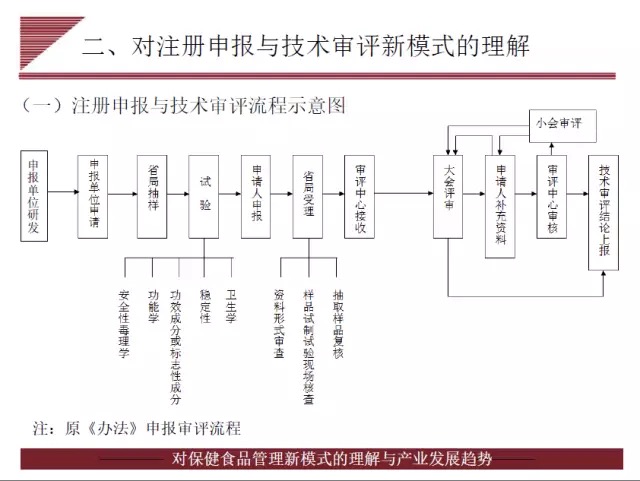
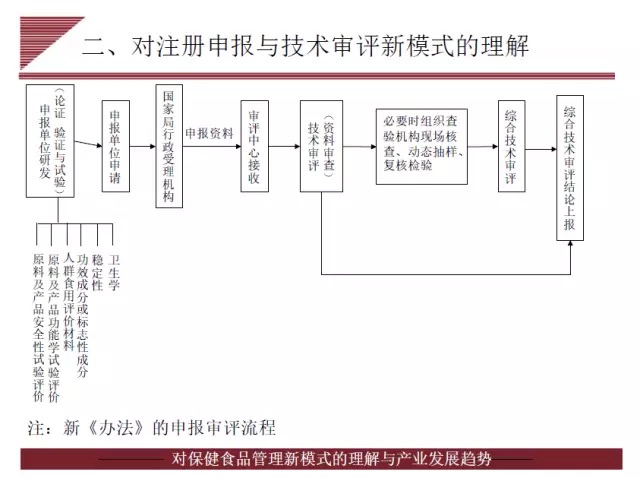
林升清强调指出,新规对研发报告提出更高的要求,必须提供产品整体研发思路、过程和可进行检查核实的结果。产品研发报告涉及的研究数据、研究记录和中试生产验证记录等原始资料应存档备查。另外,林升清透露与之配套的保健食品功能目录、实施细则、审评规定、申报资料项目要求亦将起草、发布。对于《保健食品原料目录》,林升清表示目前纳入的只是有国标的营养素补充剂,其他原料短时间内难以列入。
北京清华长庚医院杨勤兵主任医师向与会者讲述了《我国特殊医学用途配方食品——法规现状及展望》,对特医食品已发布的注册管理办法,一个规范标准和两个产品标准进行了详细解析。
杨勤兵表示特殊医学用途配方食品虽然在国内应用已有30多年,但长期作为药品管理,而且没有国家标准,限制产品发展,因此造成许多难以解决逾越的注册问题,导致许多在国外已有多年使用历史且效果良好的产品无法服务于中国消费者,使患者不合理营养。为满足临床病人对特殊医学用途配方食品的需求,促进产品研发和应用,以后应该继续建立与国际接轨的相关配套国际标准体系。
国家食品安全风险评估中心领导徐主任详细讲解了卫计委、CFDA历年发布的保健食品原料涉及的各种法规(比如鱼肝油、生何首乌、破壁灵芝孢子粉等),以及保健食品、新食品原料安全性评估的概念、方法,表示卫生部和食药监局对保健食品的安全性提出了一系列的要求,从限定原料的选择来确保保健食品的安全性。
在回答与会者关于《保健食品原料目录》(征求意见稿)的问题时,徐主任表示征求意见稿应该与正式稿差别不大,营养素补充剂允许备案的用量会低于2005年发布的《营养素补充剂申报与审评规定(试行)》,目前企业可以参考征求意见稿研发备案产品,备案时必须要对应允许备案的用量、化合物名称、执行标准及人群适用范围。

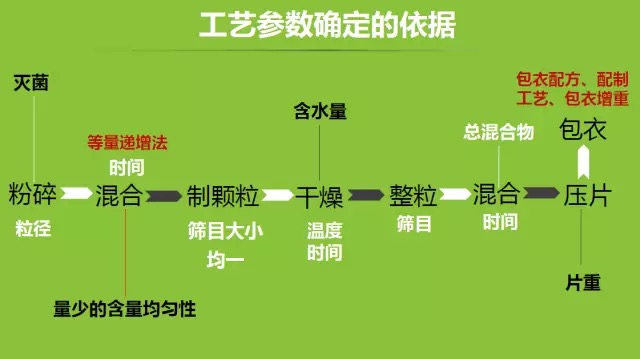
从事中药新药及保健食品研究与开发的长春中医药大学教授张炜煜做了题为《保健食品生产工艺新规的解读及审评要点》报告,分别具体讲述了注册制、备案制对申报资料的要求及审评原则,研发报告和生产工艺资料格式,剂型选择依据,提取工艺的研究,辅料选择的依据,工艺参数确定的依据,生产工艺简图及工艺说明等产品申报需要注意的问题。
张炜煜特别强调,提取物的产品企标中感官颜色应设定范围,提取工艺正交试验考察因素应设定合理,产品工艺图要规范、完善,应包括所有的工艺步骤及参数,不能缺项(比如中间体控制标准等),三批中试验证数据每一步骤均要有得量和得率。
中国商品学会副会长、北京中医药大学中药学教授张贵君在《保健食品中药配方原则及研发思路》中讲述,中华民族有着悠久的食疗、药膳养生传统,中药作为保健食品原料要以中医药理论、中药药效组分理论为支撑,要严格使用剂量,确保长期食用安全。同时,保健食品原料必须是已知的食品原料,不可标新立异,不能强行将某种认为有创新性但没有食用习惯和保健功能的物质作为某种保健食品研制。

张贵君指出保健食品的一个缺陷——中药作为原料没有儿童的剂量,应该引起高度重视!少年儿童应该要有专用的保健食品,1~3岁婴幼儿不提倡用保健食品。张贵君还提醒与会者,保健食品的理化、毒理、功能等评价要在CFDA认定的检验机构进行,否则不会被评审专家认可。
中国老年学及老年医学学会老年营养与食品专业委员会主任付萍教授在会上,做了《保健食品注册制与备案制营养素原料名单及用量解析》报告,首先以自身经历生动回顾了中国保健食品从“药健”到“卫食”再到“国食”的发展历程与政策变革,表示2015年中国保健食品的产值达4000亿元,经过近30年的发展,营养素补充剂实施备案制已经基本成熟,将正式进入两种管理方式并存的时代。

随后,付萍详细解析了《保健食品原料目录》(征求意见稿),表示适用备案制的只有部分营养素补充剂,仅有国标或中国药典或卫生部标准的才被纳入其中。相比2005年发布的现行注册制《营养素补充剂申报与审评规定(试行)》,征求意见稿中允许备案的维生素及矿物质大类由25类缩减至22类,钼、铬、维生素K2均未列入,同时原料(化合物)总数由112种缩减至61种,减少近一半。而且,用量范围变窄,并根据人群进行了划分。以维生素C为例,成人用量范围是20~200毫克。而《营养素补充剂申报与审评规定(试行)》中维生素C的用量范围是30~500毫克。
付萍表示,用量范围显得较保守是为了安全,列入原料目录之内的营养素补充剂可以备案,没列入的仍注册;符合备案用量的营养素补充剂可以备案,用量之外的仍注册。另外,付萍解读预混料应该是可以备案的,但必须把每一种维生素、矿物质列出,并均符合备案要求。最后,付萍还讲解了国内外营养素补充剂法规规定用量,预包装食品标签如何规范、合理有效标示。
据悉,此次研讨会吸引了来自全国各地将近200家企业参与其中,是保健食品行业人士一个很好的沟通交流学习的专业平台。
