大牌评审专家深入解析保健食品新法研发申报
2017-04-17

2017年4月8-9日,由中国保健协会食物营养与安全专业委员会主办,北京中健天行医药科技有限公司协办的“2017保健食品新法规研发申报”专题研讨会在京成功举办。本次研讨会有众多大牌评审专家出席,深入探讨《保健食品注册与备案管理办法》及保健食品立项调研、新品研发、配方配伍、生产工艺等相关内容。

中国中医科学院中药研究所,国家食药监总局保健食品审评专家张保献在会中,以《基于新的保健食品技术法规下的生产工艺审评要点》为主题,针对已经正式实施的《保健食品注册与备案管理办法》中关于产品的注册流程、审评流程及研发报告中生产工艺研究部分做了技术型解析。
张保献教授提到,《保健食品注册与备案管理办法》于2016年7月1日实施以来,主要分为两类:注册制与备案制,相对以往的注册流程做了颠覆性改变,新的审评流程也由专家审评改为内审,原料标准可由企业研究制定后报省局备案后即可生产,进行全国销售。
张保献教授强调,注册申请人应提供详细的功效成分或标志性成分检测方法以及检测方法的适用性、重现性等方法学研究材料。营养补充剂和纯度在98%以上的原料可不提供生产工艺,对除营养补充剂和纯度在98%以上的原料外的原料,应提供原料的生产工艺。提取物的生产工艺流程图要尽量详细,最好附有工艺说明,注意用酶的种类、注意加工助剂的许可使用与否、注意所用技术有无特殊要求、 注意提取率(出膏率) 、水解应说明酸的种类。

中国中医科学院首席研究员,国家食药监总局保健食品审评专家叶祖光在会中,以《中药保健食品研发的动态》为主题,根据《食品安全法》、《保健食品注册办法》、《CFDA补充规定及技术要求有关指导原则》方面展开深入讲解。
新的注册管理办法当中明确规定,自发放《审评意见通知书》电子审评意见后5个工作日开始计时,注册申请人应在3个月内一次提交补充材料,逾期则将面临退审,另一方面注册相关费用也明显提高,申报难度及监管审评力度加大,目前普遍要求做两个标志性成分,标志性成分需要和功能密切相关。
叶祖光教授提到大部分原料提取物没有行业标准或国家标准,常见出现的问题包括(生产工艺不清、得率不准确、使用禁用加工助剂(如二氯甲烷)、使用禁用的原料或部位、添加标志性物质纯品、隐瞒实际的工艺、同一提取物不同企业质量要求差别大),推荐各企业使用中医经典方进行配伍,中西合璧,珠联璧合。例如骨密度:钙、氨糖等,抗氧化、美容:葡萄籽、VE。免疫:纳豆加灵芝等。

北京中医药大学教授,国家食药监总局保健食品审评专家张贵君在会中,以《保健食品中药配方原则和产品研发的相关问题》为主题展开深入讲解,其中提到中医药要继续发展下去,必须回到两千年前,从传统的中医药理论和临床实践中寻找答案。
张贵君教授对相关企业提出不能强行将某种认为有创新性但没有食用习惯和保健功能的物质作为某种保健食品研制开发,合成原料慎用、少用,或不用。同时中药作为原料没有儿童的剂量,应该引起高度重视!少年儿童应该要有专用的保健食品,1~3岁婴幼儿不提倡用保健食品。
原辅料的选择依据方面,注意参考文献要达到要求的数量(每个原料每项内容3~5篇文献)合理性:要按照中医药理论论述并有实践性参考文献,尤其是申报两个功能的注意两个功能的相关性论述。保健食品的原料必须是已知的食品原料,不可标新立异。

原食药总局保健食品审评中心主任,现中国保健协会副理事长黄建生在会中,以《保健食品注册与备案管理办法》为主题展开深入讲解,从办法的法律依据、备案管理及注册管理主要涉及内容进行探讨。
黄建生提到办法对保健食品等特殊食品实行严格监督管理,将保健食品产品上市的管理模式由原来的单一注册制调整为注册与备案相结合的分类管理模式。并提出总局和省级局管理的权限。
保健食品许可分类分级管理表


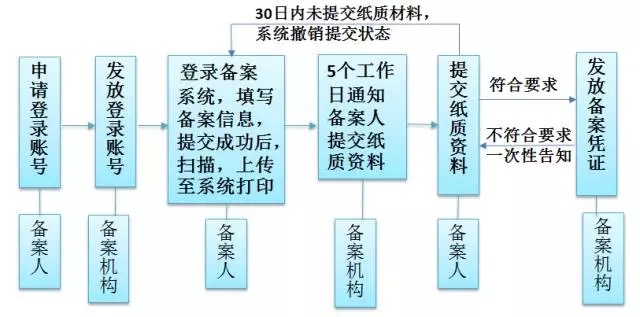
备案产品基本要求应使用已经列入保健食品原料目录,保健功能已经列入保健食品功能目录,国产和进口产品都需要10多项材料,备案材料符合要求的,当场备案;不符合要求的,应当一次告知备案人补正相关材料,备案程序与注册程序相比,简单了很多,备案管理要对产品配方、原辅料名称及用量、功效、生产工艺等要求制定详细统一的规定,以适应省级食药局要求,备案工作实施后将会产生很多需要解决的问题。
《备案细则》的备案流程图

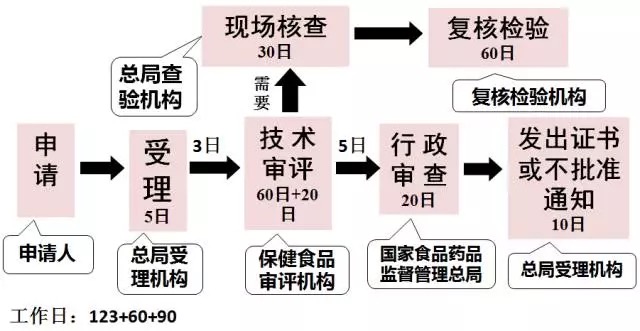
注册程序方面优化了保健食品注册程序,以受理为注册审批起点,将现场核查和复核检验调至审评环节,由审评机构统一组织现场核查和复核检验,使各项流程紧密衔接,补充资料方面,应当一次告知需要补正的全部内容。注册制度最重要的改革是技术审评结论由专家委员会做出,变为了由审评中心作出,注册难度较以往难度增大很多。
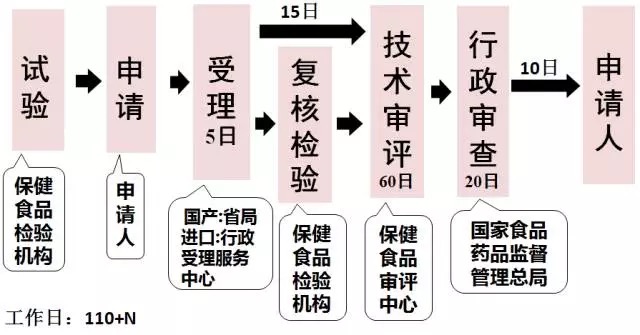
原注册程序

2016年7月1日执行的注册程序



东南大学公共卫生学院教授,国家食药监总局保健食品审评专家孙桂菊在会中分别从《新政下保健食品功能学检验与评价》及《保健食品毒理学评价试验常见问题》展开讲解,深入探讨新政下保健食品功能评价试验及毒理学评价试验。
孙桂菊教授讲到安全性和保健功能评价试验应送往国家指定的检验机构检验,对送检的保健食品进行的以验证保健功能为目的的试验,包括动物试验和人群食用评价试验,出具相应的检验报告。
以普通食品、卫计委规定的药食同源物质、卫计委批准的新食品原料为原料生产的,无需进行毒性试验的保健食品,服用量与常规用量相同需做急性毒性、三项致突变试验,服用量大于常规用量的,还需加做30天喂养试验,必要时进行传统致畸试验和第三阶段毒性试验。由于实验操作不规范,根据提供的检验报告无法评价产品的安全性,需要做除30天/90天喂养试验以外的毒理学试验。
