我司举办“新政下保健食品、特医食品研发申报疑难”研讨会
2017-06-14
2017年6月2-4日,北京中健天行医药分别在北京、杭州两地与两协会举办了“新政下保健食品、特医食品研发申报疑难”专题研讨会,邀请国家级技术审评专家、新法规起草人到会进行详细讲解,深入探讨新政下保健食品注册申报审评、立项研发及特医食品临床应用相关问题。

(杭州会场)

(北京会场)
北京中健天行医药在两地会场中均设立了申报咨询展台,同时为企业提供了《保健食品新法汇编》,受到与会企业人员一致好评和欢迎。以下为会议讲课主要内容(如需汇编及课件可与我们联系)。


叶祖光教授提到新政下注册申请人应在3个月内一次提交补充材料,申报难度及审评力度加大,注册相关费用也明显提高。叶教授建议企业使用中医经典方进行配伍,中西合璧,珠联璧合。例如增加骨密度:钙、氨糖等;抗氧化:葡萄籽、维生素E。

林升清强调新政对保健食品研发提出更高要求,只有认真进行生产研制和研究论证,申报资料足以证明其安全性、有效性和质量可控性的产品才能获得建议予以注册,现场核查认为无法溯源、复现或存在重大缺陷的,均可终止审评,建议不予注册,以减少审评资源的浪费。而备案程序与注册程序相比,简单很多,备案管理对产品配方、原辅料名称及用量、功效、生产工艺等要求制定详细统一的规定,以适应各省级食药局要求。

范青生教授讲到保健食品立项研发上应遵循十大原则,开发调研先行、选题思路清晰、配方新颖合理、原料来源合法、有效成分明确、用量安全可靠、依据充足全面、配方工艺协调、原料证明齐全、文献资料充足。在工艺风险控制方面应提供中试以上生产规模的工艺验证报告及样品自检报告,无适用的国家标准、地方标准、行业标准的原料,应提供详细的制备工艺、工艺说明及工艺合理性依据。

吕圭源教授强调使用原(辅)料不在规定范围的,须按照新资源食品的要求进行安全性独立学评价并提供相关资料后使用。 原辅料用量方面在保证功能和安全用量范围内建议在《中国药典》记载药物的常用量1/2-1/3范围内(与汤剂、丸剂相比,提取后可以增效,故减少使用剂量)。性味平和的动植物物品用量不宜超过国家相关标准规定的上限剂量。如超过上述剂量应提供安全依据文献。

李可基教授讲述了新办法中保健食品注册程序,以受理为注册审批起点,将现场核查和复核检验调至审评环节,由审评机构统一组织现场核查和复核检验,使各项流程紧密衔接。注册制度最重要的改革是技术审评结论由专家委员会做出变为了由审评中心作出,逐步落实技术审评“内审负责制”,注册难度较以往难度增大很多。
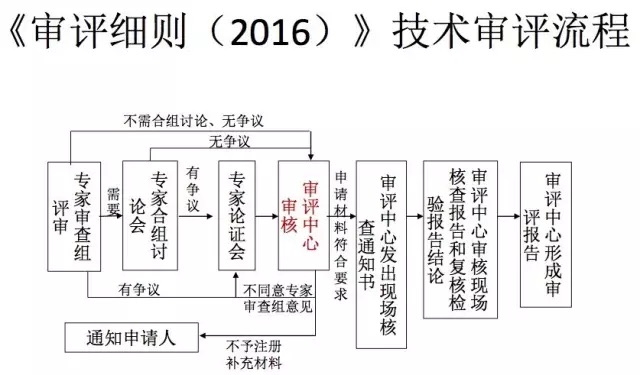

付萍主任报告中讲述保健食品新办法强化研发主体责任,提高保健食品研发水平和可追溯性的新要求。产品研发报告应包括研发人、研发时间、研制过程、中试规模以上的验证数据,目录外原料及产品安全性、保健功能、质量可控性的论证报告和相关科学依据,以及根据研发结果综合确定的产品技术要求等。这就要求我们所提供的研发报告必须体现整体研发思路、过程和可进行检查核实的结果,其中的科学文献依据包括科学文献、科研试验、权威信息和统计数据等,并分类、汇总和分析。

陈伟详细阐述了特医食品的发展历程、分类和标准,以及与保健食品、膳食补充剂的区别,着重强调特医食品相关新法规严格规定了生产过程中各项要求,重视控制产品的整个生产环节,重点关注整个生产过程中微生物的控制,配套的规范将设定一定的准入门槛,企业进入该领域还需多加考虑。

颜崇超博士提到特医食品试验实施条件应当为药物临床试验机构,具有营养科室和经过认定的与所研究的特医食品相关的专业科室,具体开展特医食品临床试验研究条件。临床开始前需向伦理委员会提交临床试验方案、知情同意书、病例报告表、研究者手册以及有法定资质的食品检验机构出具的试验用产品合格的检验报告等资料,经审议同意方可进行临床试验。
临床试验用产品由申请人提供,生产条件应满足《特殊医学用途配方食品良好生产规范》,用于临床试验用对照样品应当是已获批准的相同类别的特定全营养配方食品,如无该类产品,可用已获批准的全营养配方食品或相应类别的肠内营养制剂。
