2025年第四季度审评中心保健食品审评审批动态
2025-12-31
2025年第四季度,国家市场监督管理总局食品审评中心(以下简称“审评中心”)持续深化保健食品审评审批全流程规范化建设,聚焦行业合规升级与高质量发展需求,实现审评意见出具、核查确认、批件发放等环节的精准衔接与高效运转,为保健食品行业年末收尾及次年发展奠定坚实监管基础。本动态基于审评中心公开的官方数据,从政策发布、审评意见发放、核查与批件发放等核心维度展开详细分析。
PART 1 政策发布
第四季度,审评中心围绕备案管理创新、申报行为规范等行业核心关切,发布3项关键政策指引文件,同步推进专题宣贯筹备工作,进一步夯实行业合规发展制度保障。
《关于举办国产复方配伍保健食品备案管理试点工作宣贯会的预通知》(2025年10月11日发布):为推进国产复方配伍保健食品备案管理试点工作落地实施,明确宣贯会核心内容包括试点政策解读、备案流程说明、材料撰写规范等,助力相关企业精准把握试点要求,推动复方配伍保健食品备案管理模式创新与实践落地。
《保健食品注册现场核查常见问题及解答(一)》(2025年10月17日发布):聚焦保健食品注册现场核查环节的高频疑问,其第一部分重点解答了核查范围界定、核查资料准备、生产工艺核查要点等核心问题,明确核查标准与判定依据,帮助企业提前梳理核查风险点,规范核查应对流程,有效提升企业通过核查的效率,保障注册审批全流程顺畅推进。
《关于规范注册申报委托办理行为的公告》(2025年11月21日发布):针对行业内注册申报委托办理环节存在的流程不规范、责任划分不清晰等痛点,明确委托办理的适用范围、资质要求、材料提交标准及双方权利义务,强化申报材料真实性核查责任,有效防范委托代办带来的合规风险,为企业规范申报提供明确遵循。
PART 2 审评意见通知书发放
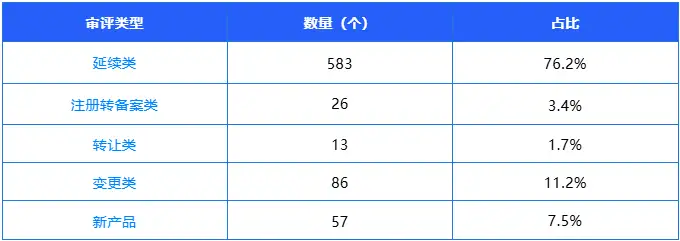
2025年第四季度,审评中心共发布保健食品审评意见通知书765个,较第三季度(262个)大幅增长2.9倍,审批效率显著提升;覆盖转让、延续、变更、注册转备案及新产品五大核心类别,各类别需求分布呈现年末集中特征,与第三季度行业需求结构形成鲜明对比,具体数据及分析如下:
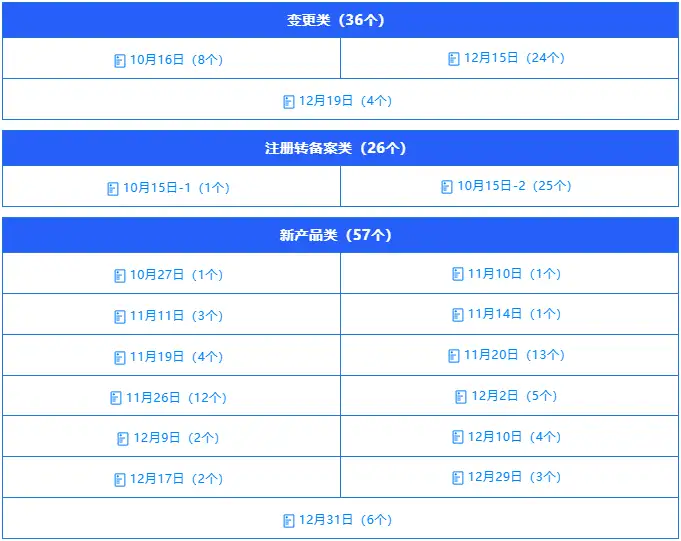
延续类:583个(占比76.2%),较第三季度(138个)增长3.2倍,占比提升23.5个百分点,成为本季度绝对核心需求。这一变化既反映出年末行业存量产品资质延续需求集中释放,也体现出审评中心针对年末高峰期优化审核流程、提升审批效率的成效,保障企业产品资质平稳衔接。
变更类:86个(占比11.2%),较第三季度(41个)增长1.1倍,占比提升4.4个百分点。变更需求集中在产品技术要求优化、标签说明书合规整改、生产工艺调整等方面,与第三季度相比,企业合规意识进一步强化,主动适配监管要求与消费市场升级需求的意愿更强烈。
注册转备案类:26个(占比3.4%),较第三季度(46个)减少43.5%,占比下降14.2个百分点。随着注册与备案双轨制持续深化,符合备案条件的原注册产品已完成大部分类别转换,转备案节奏进入平稳收尾阶段,行业产品管理体系进一步理顺,与第三季度“转备案通道畅通”的阶段性特征形成衔接。
转让类:13个(占比1.7%),较第三季度(37个)减少64.9%,占比下降12.4个百分点。与第三季度“资源整合活跃”相比,企业资源整合节奏放缓,转让需求阶段性收缩,符合行业年末经营规划的常规规律。
新产品:57个(占比7.5%),较第三季度(6个)大幅增长8.5倍,占比提升5.2个百分点。这一变化打破了前三季度新产品申报出具审评意见低位运行的态势,核心原因在于审评中心年末集中推进新产品审评工作,在本季度2024年申报受理的新产品已出具42个审评意见,既体现了审评中心攻坚积压任务的成效,也为后续新增申报腾出了审批资源,将进一步激发企业研发创新的积极性。
| 审评类型 | 数量(个) | 占比 |
|
延续类 |
583 | 76.2% |
|
注册转备案类 |
26 |
3.4% |
| 转让类 | 13 | 1.7% |
| 变更类 | 86 | 11.2% |
| 新产品 | 57 | 7.5% |

PART 3 核查通知与批件发放
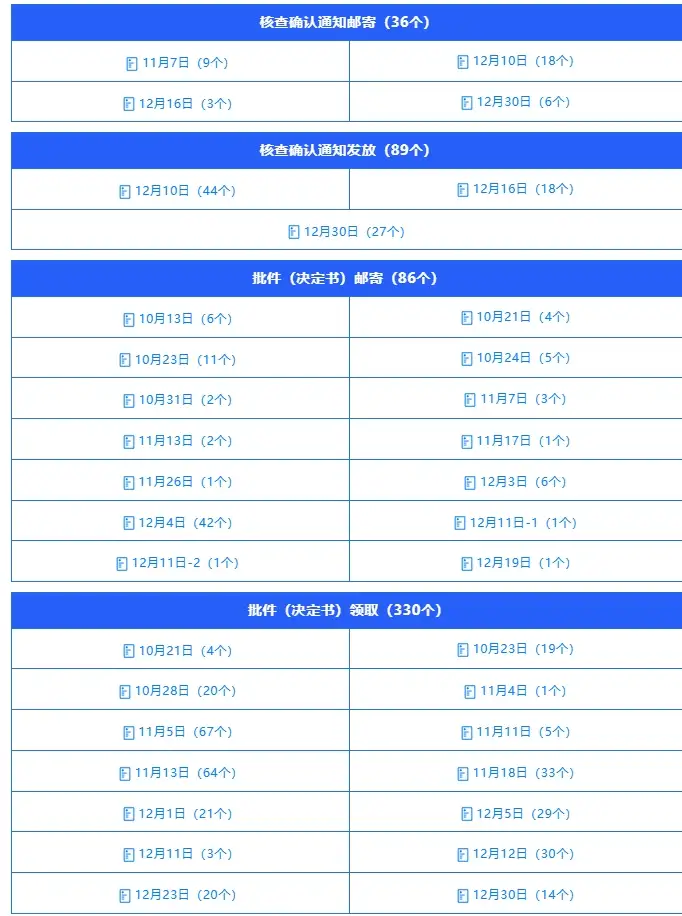
在审评意见出具的基础上,审评中心继续高效推进核查确认与批件发放环节,强化全流程闭环管理,确保审批结果及时落地。本季度共发送核查确认通知125个,完成批件(决定书)邮寄86个、通知领取330个,两类渠道合计覆盖416个审批事项。