收藏备用!国产复方配伍保健食品备案实操答疑
2025-09-26

健康中国战略推进中,消费者对兼具传统养生理念与现代安全标准的保健食品需求渐增,尤以中医理论指导的复方配伍产品为行业创新重点。此前,这类产品因原料复杂、评价标准不统一,多依赖注册管理,流程长、成本高,制约了优质供给。国产复方配伍保健食品备案试点政策,既是对保健食品“注册与备案双轨运行”机制的深化,更搭建了中医药特色健康产品合规高效的市场化通道。
1. 试点“准入门槛”:严选备案主体,筑牢安全根基
试点工作的核心前提是确保参与主体的合规性与专业性,为此政策对“试点备案人”设定了明确且严格的资质条件,避免了“空壳企业”参与试点,确保备案人有成熟的生产经验,从源头把控产品安全。
2. 产品“合规标尺”:原料、配方、功效全维度约束
试点产品的核心要求是“安全、可控、有依据”,政策从原料、配方、功效声称等维度设定了清晰的规范,既尊重中医药配伍规律,又符合现代保健食品监管逻辑。
3. 试点的多重价值:为健康产业注入新动能
试点意义远超“简化备案流程”,而是从行业、消费者、政策体系三方面赋能健康产业发展:
对行业:打破复方保健食品“注册难、周期长”瓶颈,降低优质企业创新成本,鼓励中医理论指导的产品研发,推动保健食品从“单一营养素补充”向“复合养生功能”升级,助力行业高质量转型。
对消费者:试点产品经严格原料、功能审查,监管全程透明,提供更多“安全可靠、贴合传统养生需求”的选择,减少对“三无”产品的担忧,提升健康消费体验。
对政策体系:试点积累的原料配伍数据、功能评价方法及监管经验,为全国性复方保健食品原料目录、保健功能目录制定提供实践支撑,推动备案管理制度完善,为后续政策推广奠基。
从政策设计到监管落地,试点既体现对中医药文化的尊重,也彰显“安全优先、规范发展”的监管思路。随着试点推进,期待更多兼具传统智慧与现代标准的复方保健食品走向市场,为健康中国注入新活力,为中医药与保健食品行业深度融合开拓更广阔空间。
--附:复方备案问题答疑
01 开展国产复方配伍保健食品备案试点的流程是什么?
答:①省级申报:试点省6个月内制定细化方案,报总局批复,试点期3年;②企业申请:符合条件的备案人提交材料,省局技术审查企业能力及产品合规性;③核准生产:通过后发试点备案号,仅限省内线下销售,需公开备案信息;④全程监管:每半年报进展,建追溯体系,100例人群食用评价,违规取消资格;⑤试点转归:符合目录转常规备案,未达标取消备案(试点产品可售至保质期)。
02 试点备案的保健食品在原料数量上有哪些限制?
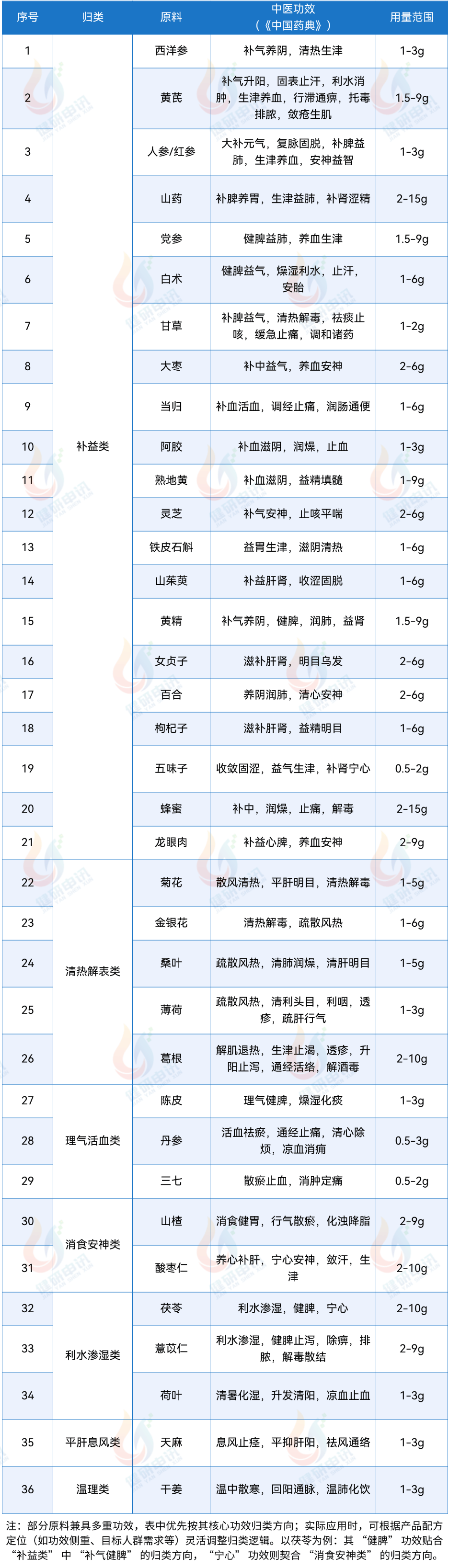
答:复方配伍原料总数不超过14个,其中食药物质之外的原料数量不得超过4个,且原料需有配伍依据,提倡精简配方。
03 试点备案产品的生产工艺有哪些限制?
答:①仅允许以物理粉碎,或以水为溶媒提取,不应再有其他引起物质基础发生改变的生产工艺(如乙醇提取等);②需提交三批次商业化生产规模的研究材料;③所用剂型应当有对应的食品或者口服药品国家标准,并在已批准注册或备案的产品中使用过;④可用辅料种类应当已列入现行《保健食品备案产品可用辅料及其使用规定》。
04 若原料需委托水提取,对委托企业有什么要求?
答:若原料水提取工艺需要委托其他企业完成,提取工序应在本省份符合要求的企业完成,且需在产品备案凭证原料技术要求中载明委托生产企业名称。
05 以传统中医养生理论为指导研发的试点产品,若需开展人体试食试验,在什么条件下可免于提供人体试食试验材料?
答:若该类试点产品在具有中医专业二级及以上医疗机构使用3年以上,能够提供300例以上可溯源的研究数据,说明人群服用产品的安全性和保健功能的,可免于提供人体试食试验材料。产品备案试点期间,备案人仍需继续监测产品的保健功能和安全性。
06 国产复方配伍保健食品备案试点产品在保健功能声称上,可选择几个保健功能?
答:备案时可选择1个或2个保健功能,功能范围需符合《允许保健食品声称的保健功能目录(2023年版)》;申报2个保健功能的,需提供不同功能可同时声称的合理性依据,确保功能之间无矛盾且适宜人群一致。
07 试点备案产品的配方中,原料需符合哪些质量要求?若原料需要炮制,有什么具体规定?
答:试点备案产品的原料应当符合现行版《中国药典》相同品种项下的相关规定,若原料有食品安全国家标准要求,其安全指标(包括农药残留及重金属等)还需符合现行标准规定。需要对原料进行炮制的,仅可使用现行版《中国药典》相同品种下列出的炮制方法,且需在产品备案时明确炮制名称。
08 备案人提交的研发报告需包含哪些核心内容?
答:需包含产品的安全性论证报告、保健功能论证报告、生产工艺研究报告、产品技术要求研究报告;若为以传统中医养生理论指导的产品,还需提供传统中医药理论的组方来源及依据。
09 试点备案产品的技术要求有什么规定?
答:①应当按照《保健食品理化及卫生指标检验与评价技术指导原则(2020年版)》等规定开展卫生学、稳定性实验,参照《保健食品注册申请服务指南》有关规定制定;②备案产品与已批准注册产品配方原料种类相同的,试点备案产品技术要求不得低于已批准注册产品的技术要求。
10 备案人提交的安全性评价材料中,哪些情况原则上可不开展毒性试验?
答:使用5年以下人工种植的人参和已列入国家卫生健康委发布的食药物质名单内的原料,且保健食品产品工艺为物理粉碎或以水为溶媒加热提取的,原则上可不开展毒性试验,但应当结合复方配伍情况、原料的使用种类和用量,对安全性进行综合评价,并提供免于毒性试验的详细说明。
11 备案人需提交的产品配方材料包括哪些内容?
答:①产品配方表,包括原料和辅料的名称及用量;②原料和辅料的质量要求、生产工艺、质量检验合格证明;③复方配伍应当遵循中医药理论,结合现代研究结果,合理确定保健功能和适宜人群;④根据组方原理,对原料炮制有明确要求的,应当注明原料的饮片规格(如生、盐制、蜜制、煅等)。
12 声称哪些保健功能的试点备案产品需提交兴奋剂、违禁药物成分等检测报告?
答:“有助于控制体内脂肪”;“缓解体力疲劳”;“有助于改善睡眠”。
13 试点原料,西洋参、党参、丹参、人参(红参)分别有什么使用禁忌?
答:西洋参、党参、丹参不宜与含有藜芦的中草药及其制品同用;人参(红参)不宜与含有藜芦、五灵脂的中草药及其制品同用。
14 复方备案试点产品,适宜人群,不适宜人群有哪些要求?
答:适宜人群为《允许保健食品声称的保健功能目录 非营养素补充剂 (2023 年版)》中保健功能相对应的人群;可结合传统中医养生理论细化人群描述。不适宜人群为少年儿童、孕妇、乳母;结合产品特点,可细化传统中医中的禁忌人群的描述。