保健食品清理换证近20年艰难落地之路及换证审评内容
2023-09-13
自2023年8月31日国家市场监管总局发布《 允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》及其配套解读文件后,很多企业咨询我们“清理换证”的相关问题,为使大家对其有更清晰、全面的理解,以便稳步推进换证工作,我们整理本篇分享给大家,今天发布第一部分《保健食品清理换证近20年艰难落地之路及换证审评内容》,明天发布第二部分《保健食品清理换证96-05年7000余“双无”产品清单》。
清理换证落地之路
早在2004年国家相关部门即已开始谋划“清理换证”。回顾历史,“清理换证”政策落地一路走来甚为艰难,时间跨越近20年,历经原国家食品药品监督管理局(SFDA)、原国家食品药品监督管理总局(CFDA)和国家市场监督管理总局(SAMR)。
01、SFDA时代
2004年12月24日,原国家食品药品监督管理局药品注册司下发《关于开展保健食品注册有关情况调查的通知》(食药监注函[2004]152号),开启清理换证摸底普查之路。
2005年3月30日,国务院办公厅关于印发《2005年全国食品药品专项整治工作安排的通知》(国办发〔2005〕20号)提及:“认真开展保健食品清理、换证工作”。
2005年9月20日,原国家食品药品监督管理局(SFDA)下发《保健食品清理换证方案(征求意见稿)》。
2005年11月24日,原国家食品药品监督管理局(SFDA)再发布征求《保健食品清理换证方案(送审稿)》意见的通告,附件1中列出29个已撤销保健食品批准证书的清单。
2009年7月21日,原国家食品药品监督局发布《关于开展保健食品基本情况调查和确认工作的通知(食药监办许函[2009]280号) 》,表示将适时开展保健食品产品清理换证和再注册工作,对卫生部和国家局批准的保健食品产品基本情况进行调查摸底和确认。
2010年5月5日,原国家食品药品监督局(SFDA)印发《2010年保健食品安全整顿工作实施方案》,表示:“待《保健食品监督管理条例》出台后,依法对获批注册但未标明有效期的保健食品进行全面清理换证。”
2012年9月18日,原国家食品药品监督局(SFDA)发布《保健食品清理换证工作方案(征求意见稿)》意见的函(食药监保化函[2012]425号)。
02、CFDA时代
2013年3月14日,根据第十二届全国人民代表大会第一次会议审议通过的《国务院机构改革和职能转变方案》,组建国家食品药品监督管理总局(CFDA),不再保留国家食品药品监督管理局(SFDA)。
2015年3月25~26日,全国保健食品监督管理工作会议在北京召开,会议指出“完善注册、备案管理制度,全面启动清理换证”。
2015年10月1日,新食安法正式实施。
2016年2月26日,国家食品药品监督管理总局(CFDA)发布《保健食品注册与备案管理办法》解读,第十七条:“对现有已批准注册的保健食品,采取分期分批、依法合规、稳步推进的原则开展清理换证工作。通过清理换证,使新老产品审评标准保持一致。清理换证方案另行规定。”
03、SAMR时代
2018年3月13日,根据第十三届全国人民代表大会第一次会议审议通过的《国务院机构改革方案》,组建国家市场监督管理总局(SAMR),不再保留国家食品药品监督管理总局(CFDA)。
2019年8月20日,国家市场监管总局召开专题新闻发布会,介绍《保健食品标注警示用语指南》和《保健食品原料目录与保健功能目录管理办法》总体情况,表示会有序开展换证清理工作。
2022年1月13日,国家市场监管总局(SAMR)发布《关于发布允许保健食品声称的保健功能目录 非营养素补充剂(2022年版)及配套文件》的公告(征求意见稿),纳入新旧功能的衔接措施,即俗称的“清理换证”。
2023年8月31日,国家市场监管总局发布《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》,配套解读文件中明确了“老功能声称”和“双无”产品过渡要求,至此“清理换证”终于落地。
清理换证审评内容
根据《 允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》及其配套解读文件(以下简称“23版功能目录”),保健功能调整为24个,较之03版,删除“改善生长发育”、“促进泌乳”和“改善皮肤油分”。设置5年过渡期,企业需在5年内完成换证工作。
01、“老功能声称”产品
对于列入23版功能目录的产品,相对简单,仅仅规范保健功能声称,企业可单独提出功能名称变更,也可在办理其他变更、延续等事项时规范;在审产品审评机构将直接调整,企业无需操作;对于未列入23版功能目录的产品,可申请纳入(难度巨大)或放弃此功能去变更23版目录内功能。
02、“双无”产品
“双无”产品主要是指2005年7月1日前原卫生部和国家食品药品监督管理局(SFDA)批准的保健食品,其颁发的保健食品批准证书未注明证书的有效期,也无技术要求。据健研申讯最新统计,原卫生部自1996年11月4日至2003年7月8日,共批准5200个(含已注销/撤消产品),其中卫食健字4749个,卫食健进字237个,卫进食健字214个;原国家食品药品监督管理局(SFDA)自2003年10月完成原卫生部移交工作、正式启动保健食品审批工作至2005年7月1日前,共计批准2132个。因此,“双无”产品总共估计7000余个,占到目前批准功能产品的1/3以上,涉及企业4700余家,可见清理换证规模之庞大,影响之广泛,将会对保健食品批文格局以及市场产生重大变化和深远影响。也由此不难理解,清理换证落地之所以历时近20年之久,工作之繁重,任务之艰巨,牵一发而动全身。在此向为推动清理换证落地付出艰苦卓越努力的国家局、各地省局以及协会、专家等致敬!
据悉,“清理换证”将采取分期分批、依法合规、稳步推进的原则开展清理换证工作,最终使新老产品审评标准保持一致。“双无”产品需首先通过省级市场监管部门意见,对于在生产产品,会优先处理,而未进行过实际生产“闲置”产品换证之路或许较为艰难坎坷,我们建议有条件的企业可咨询各地省局考虑尽快落证生产。另外,原功能依据为96版评价方法的产品,有8个功能需补做功能试验,建议企业尽快送检,在检验期间同步进行换证其他工作,以缩短换证周期。
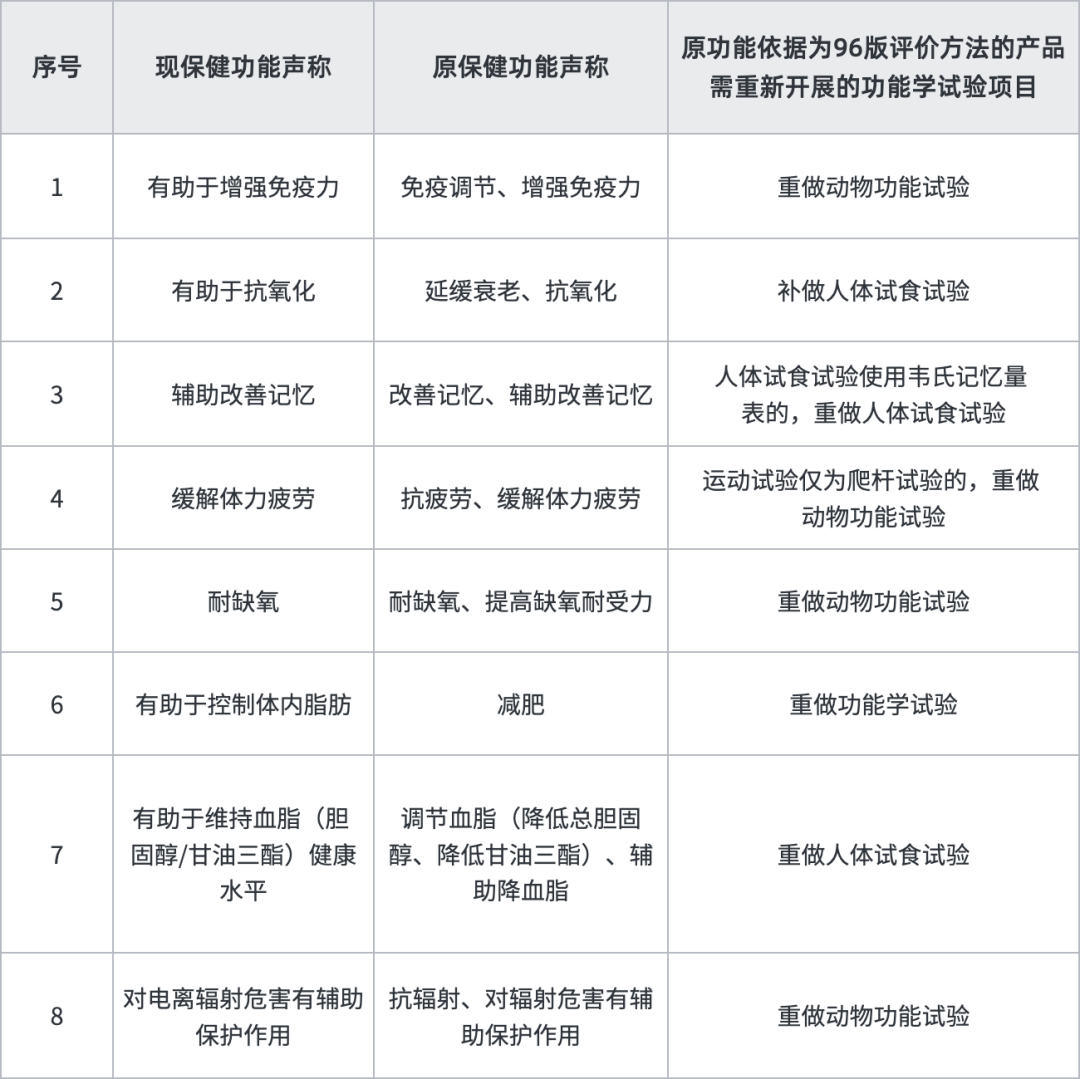
按照我们经验,换证审评除上述明确补做内容外,将会对保健食品产品名称、说明书(如标示值、服用量、适宜人群等)、技术要求(如标志性成分,提取物工艺等)及生产工艺按照新法规进行审评予以规范,比如:不属于普通食品、新食品原料、食品添加剂及可用物品名单内的原料或用量不符合现行规定的需提供食用安全的文献等资料或要求调整用量;无标志性成分或标志性成分检测方法不符合现行规定的,需补订标志性成分以及提供方法学验证资料;产品技术要求缺少指标的须按国家现行标准增订,增订指标属于稳定性重点指标的还需要提供三批稳定性报告。存在以下情形者预计将不予换证:(1)未在规定时限内提出换证申请或补充资料未在规定时限内提交或不符合要求;(2)原辅料、产品不符合现行规定(比如原料为一级野生动植物保护品种或其他禁用物品),存在食用安全问题的;(3)生产工艺无法重现,不符合现行规定的;(4)国家相关部门已撤销的保健食品批准证书。
保健食品清理换证服务
很多企业比较关心换证费用和周期,这需要根据每个产品不同情况做出具体分析,费用少则免费,多则几十万,周期少则几个月,多则三四年。近几年我们已帮助一些先行的企业进行换证相关工作,以变更事项递交,获得宝贵的审评意见和经验,欢迎企业与我们交流,我们会对换证产品进行全面评估和分析,提供经济、可行、保障的换证方案,依法合规、稳步推进,从而确保5年内顺利换证!

