在产在售“双无”保健食品换证服务
依据现行法律法规《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》及配套文件及《在产在售“无有效期和无产品技术要求”保健食品集中换证审查要点》集中规范在产在售“双无”产品注册证书,设立注册证书有效期,规范保健功能声称,完善产品标签说明书样稿、产品技术要求和产品档案信息,换发保健食品注册证书(以下简称换证),实现保健食品注册与生产许可、监管标准衔接,落实生产企业主体责任和属地管理责任。设置5年过渡期,企业需在5年内完成换证工作。
“双无”保健食品主要是指2005年7月1日前原卫生部和国家食品药品监督管理局(SFDA)批准的保健食品,其颁发的保健食品批准证书未注明证书的有效期,也无技术要求。
换证范围
过渡期内,对于在产在售的“双无”国产产品,注册人按照要求提出换证申请;对于在产在售“双无”进口产品,相关材料符合本审查要点规定的,注册人按照要求直接提出换证申请,审评机构根据换证审查需要,可以组织开展境外现场核查。
按照2023年38号公告明确的“省级局出具意见、企业提出申请、总局审评审批”换证路径,换证范围为在产在售的“双无”保健食品。
换证程序
(一)省级市场监管部门应当根据产品实际生产的技术要求和监管情况,依据现行法律法规提出产品换证意见,报送市场监管总局,并抄送注册人。
(二)注册人按照本审查要点规定准备换证材料,按照变更注册程序向市场监管总局申请换证,变更注册类别为“双无”换证。
(三)审评机构按照现行法律法规标准及有关规定开展换证审评,并将审评结论报送市场监管总局审批。符合要求的,换发新的注册证书,注册号更新为“国食健注G/J年代号+序号”(其中“年代号+序号”不变),证书备注栏标注原产品名称、原产品注册号及“原注册证书换证后失效”。不符合要求的,不予批准换证申请。注册人可依据规定要求重新提出换证申请。换发的注册证书或不予注册决定书,同时抄送注册人所在地和核发生产许可的省级市场监管部门。
(四)过渡期内,准予注册的,保健食品注册人和生产企业应当自决定之日起6个月内,严格按照新注册证书技术要求组织生产,此前生产的产品允许销售至保质期结束。转备案的,按照备案产品管理有关规定执行。
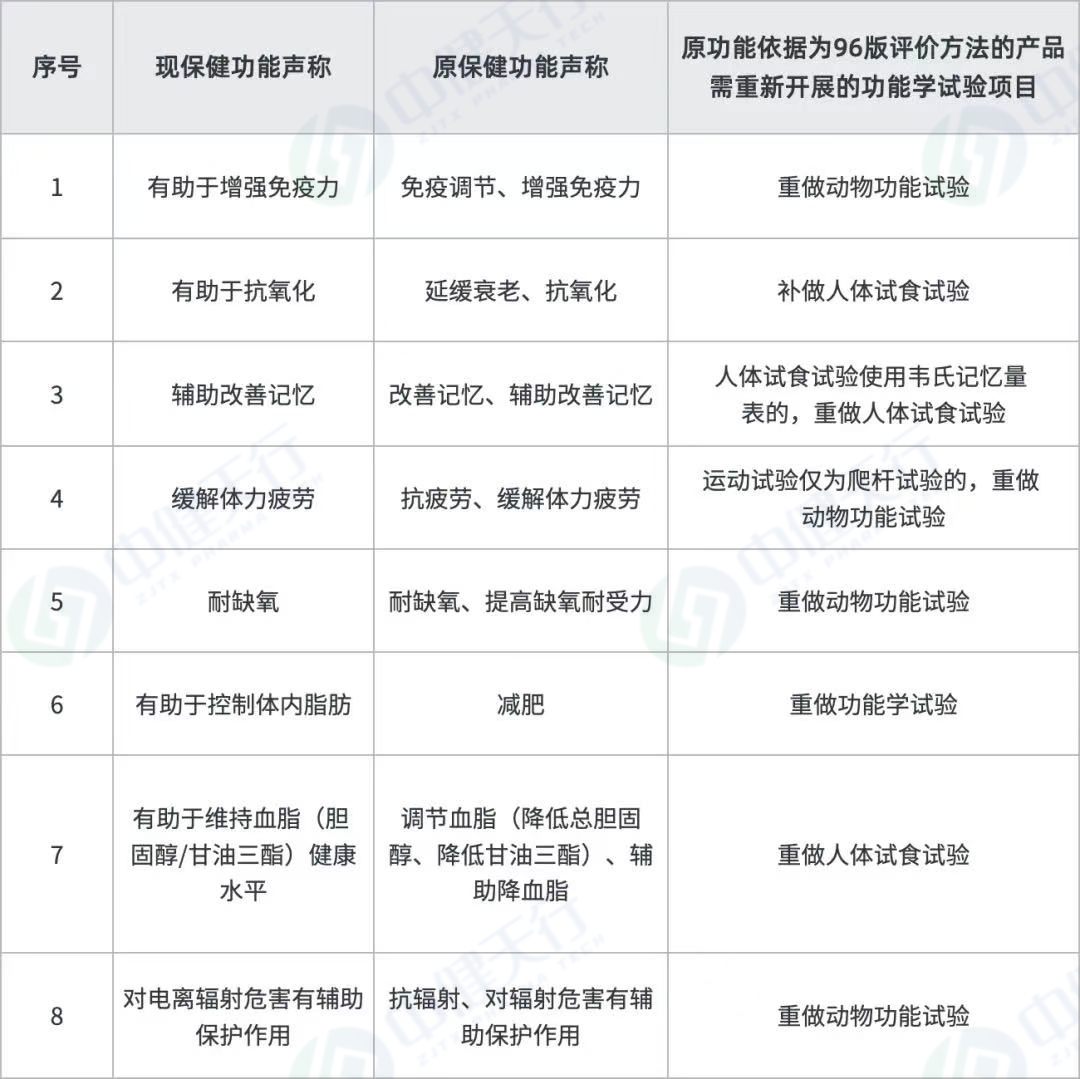
另外,原功能依据为96版评价方法的产品,有8个功能需补做功能试验,建议企业尽快送检,在检验期间同步进行换证其他工作,以缩短换证周期。
需重做或补做试验的八项保健功能目录
换证流程
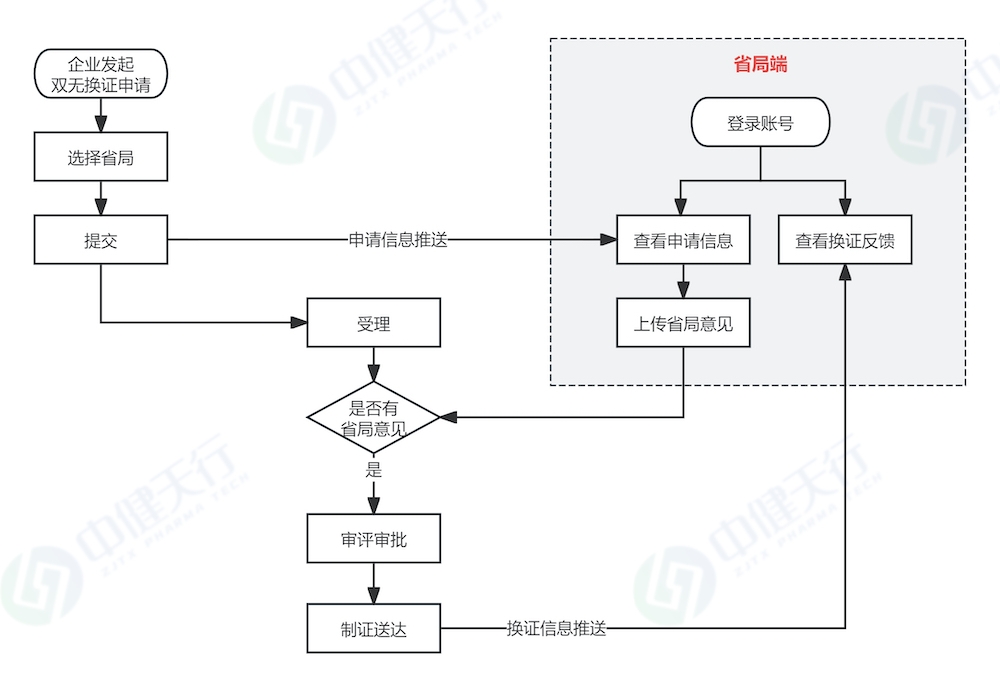
进口“双无”产品在换证流程上具有特殊性,无需省局出具换证意见。
对于国产“双无”产品,注册申请人应提前向核发生产许可的省局申请《出具换证意见》,待取得省局意见后,再在系统中发起“双无”换证申请。但是由于不同省局出具换证意见的工作方案存在差异,申请人需提前了解当地具体要求,具体可参考以下流程:
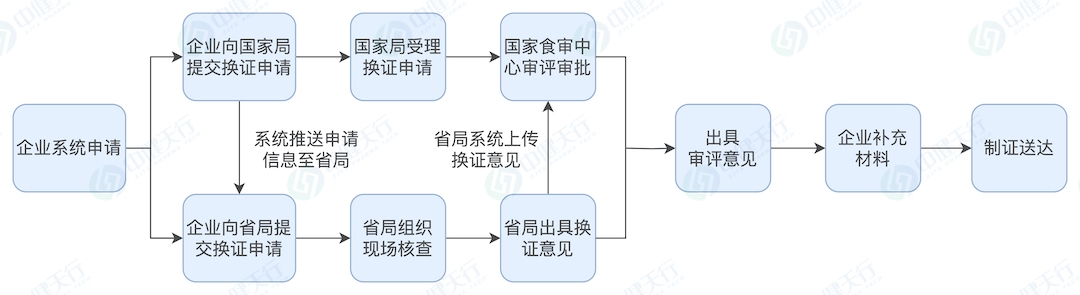
按照我们经验,换证审评除上述明确补做内容外,将会对保健食品产品名称、说明书(如标示值、服用量、适宜人群等)、技术要求(如标志性成分,提取物工艺等)及生产工艺按照新法规进行审评予以规范,比如:不属于普通食品、新食品原料、食品添加剂及可用物品名单内的原料或用量不符合现行规定的需提供食用安全的文献等资料或要求调整用量;无标志性成分或标志性成分检测方法不符合现行规定的,需补订标志性成分以及提供方法学验证资料;产品技术要求缺少指标的须按国家现行标准增订,增订指标属于稳定性重点指标的还需要提供三批稳定性报告。存在以下情形者预计将不予换证:(1)未在规定时限内提出换证申请或补充资料未在规定时限内提交或不符合要求;(2)原辅料、产品不符合现行规定(比如原料为一级野生动植物保护品种或其他禁用物品),存在食用安全问题的;(3)生产工艺无法重现,不符合现行规定的;(4)国家相关部门已撤销的保健食品批准证书。
很多企业比较关心换证费用和周期,这需要根据每个产品不同情况做出具体分析,费用少则免费,多则几十万,周期少则几个月,多则三四年。近几年我们已帮助一些先行的企业进行换证相关工作,以变更事项递交,获得宝贵的审评意见和经验,欢迎企业与我们交流,我们会对换证产品进行全面评估和分析,提供经济、可行、保障的换证方案,依法合规、稳步推进,从而确保5年内顺利换证!

